免疫と自己免疫疾患
私たちの日常生活には、病気の原因となる異物が溢れています。例えば、通勤電車で隣の人が咳をしていたら、その咳の中に風邪のウイルスがいるかもしれません。よく火が通っていないお肉には、腸管出血性大腸菌がいるかもしれません。春になれば、山からスギ花粉が飛んできます。お風呂場を湿ったまま放っておけば、そこら中にカビが生えます。ウイルスも大腸菌も花粉もカビもみんな、体に入ってくれば排除しなければならない異物です。
自分の体(の部品)とそれ以外の異物を識別して、異物を体内から排除し感染症などの病気から守ってくれているのが、私たちの体に備わっている免疫というシステムです。あなたの体の中でも、日夜(今も!)免疫の細胞たちが病気のもとになる異物と戦ってくれています。では、その体にとって強い味方であるはずの免疫系が、私たちの体を攻撃し、病気を引き起こすことがあると聞いたら、皆さんはどう思うでしょうか?坂口先生のノーベル賞受賞のニュースで、「制御性T細胞は、私たちの体を攻撃しようとする免疫を抑える働きをしている」といった説明を聞いていると思います。でもなぜ、「味方のはずの免疫系が自分自身を攻撃しようとするのだろう?」と疑問に思いませんか?坂口先生は、大学の授業で「自己免疫疾患」*1という病気の存在を知り、同じような疑問を持って制御性T細胞の発見につながる研究を始めました。
*1「自己免疫疾患」という言葉はあまり聞きなれないと感じるかもしれませんが、案外身近なものです。Ⅰ型糖尿病や、関節リウマチ、シェーグレン症候群など、皆さんも一度は聞いたことがありそうな一般的に知られている病気も自己免疫疾患に分類される病気です。
I型糖尿病:免疫が、インスリンを産生する膵臓ランゲルハンス島β細胞を破壊します。その結果インスリンの分泌量が低下し血糖値が上昇し、糖尿病を発症します。
関節リウマチ:免疫が関節の滑膜という部分を攻撃します。その結果、関節に変形が起こります。
シェーグレン症候群:免疫が涙腺と唾液腺、鼻腺を攻撃することで、涙や唾液、鼻水の分泌に異常が生じます。目や口、鼻腔の乾燥が主な症状です。
自己免疫疾患は、免疫が自分の体を攻撃してしまうことで起こる病気の総称です。でもなぜ自分の体を攻撃するなんてことが起こるのでしょうか?病気の人には自分の体を攻撃してしまう「特殊な免疫細胞」ができてしまって、その異常な免疫細胞が病気を引き起こすのでしょうか?いかにもありそうな筋書きですが、実はそうではありません。健康な人の体の中にも(あなたの体の中にも)、自分自身を攻撃する免疫細胞はいます。免疫のシステムは、彼らが自分自身を攻撃しないよう免疫の機能を制御しているのです。その免疫機能を制御するために重要な役割を担っているのが、坂口先生が発見し、長年にわたりその役割の解明を続けてきた制御性T細胞(Treg:ティーレグ)という細胞です。
そんなことを言われても、やっぱり不思議ですよね。なぜ健康な状態の免疫システムに、自分の体を攻撃してしまうような「危険な」免疫細胞がいるのでしょうか? そしてTregは、どうやってそれらの危険な細胞を制御しているのでしょうか?
それを説明するためにまず、免疫の細胞の紹介と、異物に対する免疫反応のあらましについてお話しします。(説明は長くなるので、手っ取り早く答えを知りたい方は、「問いの答え」という部分を読んでください。)
抗原に対する免疫反応:いろいろな種類の免疫細胞とその働き
免疫の細胞はたくさんの種類が知られています。その中で今回のお話に出てくるのは、樹状細胞(じゅじょうさいぼう)、マクロファージ、ヘルパーT細胞、キラーT細胞、B細胞の5種類の細胞です。大雑把に言うと、樹状細胞とマクロファージ、キラーT細胞は、ウイルスに感染した細胞や細菌などの異物を食べる(細胞の中に取り込んで分解する)役割、ヘルパーT細胞は免疫応答の司令塔の役割をもっていて、B細胞は抗体(こうたい)を作ります。抗体は異物にくっついて、免疫の攻撃対象の目印として働きます。
役者がそろったところで、インフルエンザに感染したときのことを考えてみましょう(図1)。
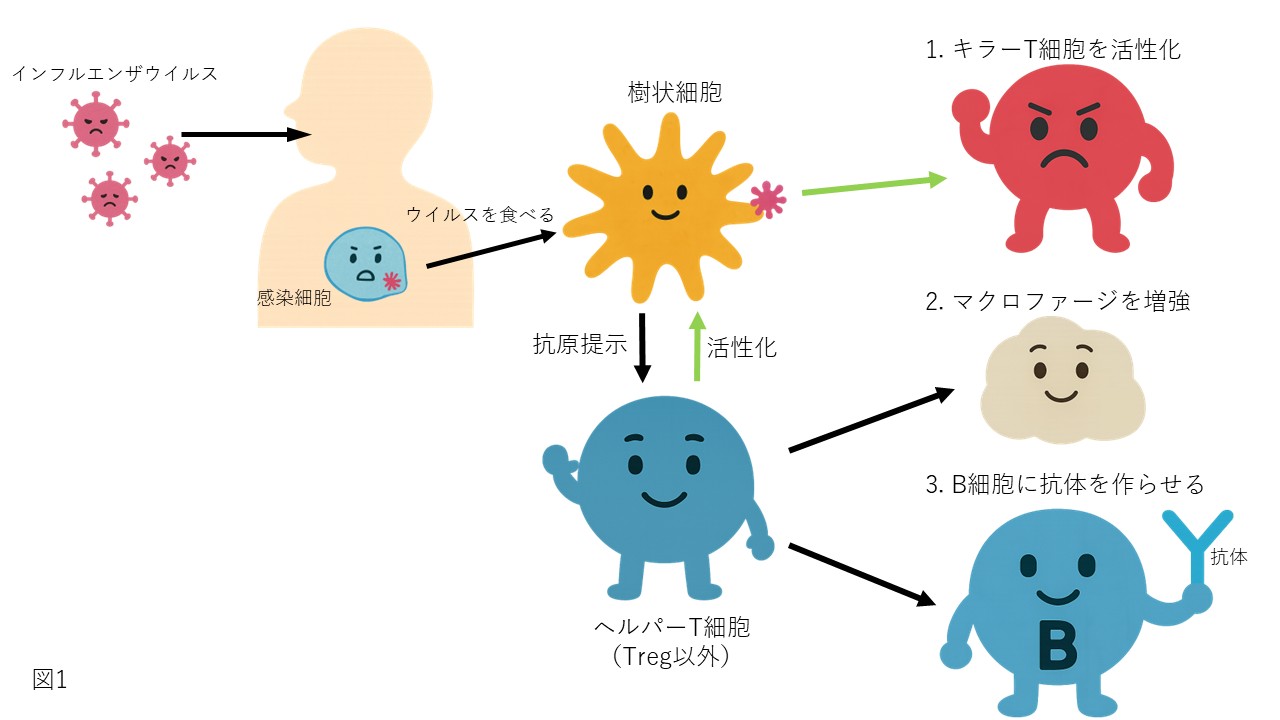
ヒトの体内に侵入したインフルエンザは細胞の中で増殖します。樹状細胞はインフルエンザウイルスを捕まえて分解し、その一部を抗原として免疫細胞に提示します。ヘルパーT細胞は、樹状細胞を活性化し、その樹状細胞を使ってキラーT細胞を活性化します(本文1、緑色矢印の経路)。また、マクロファージに作用して感染した細胞を食べる能力を増強します(本文2)。さらにB細胞に対して、抗体を作るように指示します(本文3)。
インフルエンザウイルスは、我々の体に入ると、細胞に潜り込んで、細胞の中で自分自身を増やそうとします。さて、樹状細胞がインフルエンザウイルスに感染した細胞に遭遇しました。すると、樹状細胞はその細胞を食べます(細胞内に取り込む)。樹状細胞は取り込んだ感染細胞と一緒にウイルスを分解して、分解したウイルスの断片を細胞の表面にもっていきます。この時、細胞表面に出てくるウイルスの断片を抗原(こうげん)といいます。次はヘルパーT細胞の出番です。ヘルパーT細胞は、抗原にくっつく「受容体(じゅようたい)」というものを持っています。樹状細胞が提示している抗原がヘルパーT細胞の持つ受容体にくっつくと、その細胞が働き始めます。ヘルパーT細胞は抗原とくっつかないと何もしないでぼんやりしていますが、抗原を提示した樹状細胞にくっつくとがぜんやる気を出して働き始めます(活性化)。 活性化したヘルパーT細胞は、
- 樹状細胞を活性化し、その樹状細胞を使ってキラーT細胞を活性化します*2。。活性化されたキラーT細胞は、インフルエンザウイルスに感染した細胞を破壊します。
- マクロファージに作用して感染した細胞を食べる能力を増強します。
- さらにB細胞に対して、抗体を作るように指示します*2。 と一転して一人で何役もこなす働き者になります。これだけ頑張っていれば、「免疫の司令塔」という呼び名にも納得ですね。
*2 活性化したヘルパーT細胞は、すべてのキラーT細胞、B細胞を無差別に活性化するわけではなく、同じ抗原にくっつく受容体を持つキラーT細胞、B細胞だけを活性化します。インフルエンザのウイルスをやっつけたいときに、結核菌をやっつけるための細胞を働かせても意味がないですからね。
実際には、免疫系はさらにいろいろな仕組みを使って異物に対抗しています。今回の説明はかなり簡略化されていますが、ひとまずこのくらい知っておいて頂ければ大丈夫です。抗原を感知する受容体
さて、ここからさらに細かい話になっていきます。この一連の免疫反応の中で重要な働きをしているのが、異物(抗原)にくっつく「受容体」です。T細胞がかかわる免疫反応は、受容体が抗原にくっついて異物を異物として検知することから始まりますので、非常に重要です。
受容体は、T細胞、B細胞が持っています。一口に抗原の受容体、といっても、少しずつ性質の違う受容体がたくさんあって、あるものは結核菌、あるものはインフルエンザウイルス、などそれぞれの受容体が異なる抗原にくっつくようになっています。(一つの受容体が、どんな抗原にでもくっつく、という仕組みではない、ということです。)それはつまり、抗原と同じように受容体の種類も多様だということになりますね。でも、新型コロナウイルスのように新しい病原体もどんどんできてくるし、いまだに未知のウイルスだって地球上には存在しているはずなので、今まで出会ったことのある抗原に対応できるだけでは不十分です。今知られているだけでも病原体は無数にあるのに、本当に大丈夫?と心配になってしまいますね。でも大丈夫です!もし今日、未知のウイルスに遭遇したとしても、免疫はちゃんとそれに対応できるようになっています。すごいですよね。どういう仕組みですべての異物に対応できるのでしょうか?
遺伝子再構成:多様な受容体を作る仕組み
「受容体」はたんぱく質でできていて、そのたんぱく質の設計図と呼ばれるものが「遺伝子*3」です。あなたの体を構成する無数の細胞は同じ設計図を共有して(みんな同じ設計図のコピーを持って)いますが、その設計図のうちのどの部分を使うかによって、さまざまな細胞が異なる形態や役割を発揮する仕組みになっています。しかし、全ての細胞が同じ設計図を共有しているはずのあなたの体の中で、免疫細胞のT細胞やB細胞は例外的に他とはちょっとだけ異なる設計図を持っていることが知られてます。ではどこが違っているかというと、T細胞やB細胞が抗原を認識するための「受容体」を作る設計図の部分です。T細胞やB細胞ができてくるとき、受容体の設計図が書き換えられて*4、少しずつ性質の違う受容体ができてきます。我々が持っている「たんぱく質の設計図=遺伝子」は数万程度ですが、T細胞、B細胞が作り出すことができる受容体のレパートリーは数百万と言われています。受容体のもとになる遺伝子を少しずつ書きかえて、性質が少しずつ異なる受容体を作っています(図2)。

ヒトの体内に侵入したインフルエンザは細胞の中で増殖します。樹状細胞はインフルエンザウイルスを捕まえて分解し、その一部を抗原として免疫細胞に提示します。ヘルパーT細胞は、樹状細胞を活性化し、その樹状細胞を使ってキラーT細胞を活性化します(本文1、緑色矢印の経路)。また、マクロファージに作用して感染した細胞を食べる能力を増強します(本文2)。さらにB細胞に対して、抗体を作るように指示します(本文3)。
*3:遺伝子の話をするとき、「DNA」という言葉もよく聞きますが、DNAは遺伝子の材料となるデオキシリボ核酸という物質です。
*4:遺伝子再構成と呼ばれる現象です。ちなみに、遺伝子再構成をB細胞で証明したのが利根川進先生です。B細胞が遺伝子の数よりも多い種類の抗体をなぜ作成できるのかは長年の謎でしたが、利根川先生の研究により、その仕組みが明らかになりました。また、我々が持っている遺伝情報は、全ての細胞で同一であり一生変化しないというのがそれまでの常識でしたが、それを覆す大発見になりました。利根川先生も、この業績により1987年にノーベル生理学・医学賞を受賞しています。
B細胞の遺伝子再構成について解説したウェブサイト
阪大微研のやわらかサイエンス 1987年利根川進博士のノーベル賞、何がすごい?
JT生命誌研究館 生命を分子の言葉で語るために
胸腺で行われるT細胞の選別:自己攻撃性のT細胞を取り除く
T細胞は、一つの細胞がたくさんの種類の受容体を持っているわけではなく、一つの細胞は一種類の受容体だけをもっています。つまり、それぞれのT細胞はどんな異物を認識できるか決まっていて、1つのT細胞は1種類の異物しか認識できません。T細胞のもとになる細胞(前駆細胞:ぜんくさいぼう)は骨髄(骨の中)で作られます。その後、前駆細胞は胸腺という組織に移動して、機能を持ったT細胞へと成長していきます。胸腺に移動した前駆細胞はまずすごい勢いで増殖します。増殖した前駆細胞の中で遺伝子再構成が起こり、それにより、様々な受容体を1種類だけもつT細胞がたくさん作られます。この段階では、とりあえずたくさんの種類の受容体を作ることが目的となっていて、異物にくっつく受容体だけでなく、自分の体にくっつく(自分の体を攻撃する可能性のある)受容体も多くできてきます。そういう事故を攻撃してしまうT細胞はそのままにしておくと危険です。成熟して働き始める前に、胸腺の中で取り除く必要があります。
胸腺では、遺伝子再構成後の未成熟なT細胞に対して、「自己抗原」を提示し、反応の強さをチェックします。まったく反応しないT細胞は、異物にも反応できない“働かない細胞”として排除されます。逆に、自己抗原に強く反応するT細胞は、自己免疫の危険があるため排除されます。適度な強さでくっつくT細胞が合格とされて体内で働くことを許され、成熟後胸腺の外に出してもらえるようになります(図3)。
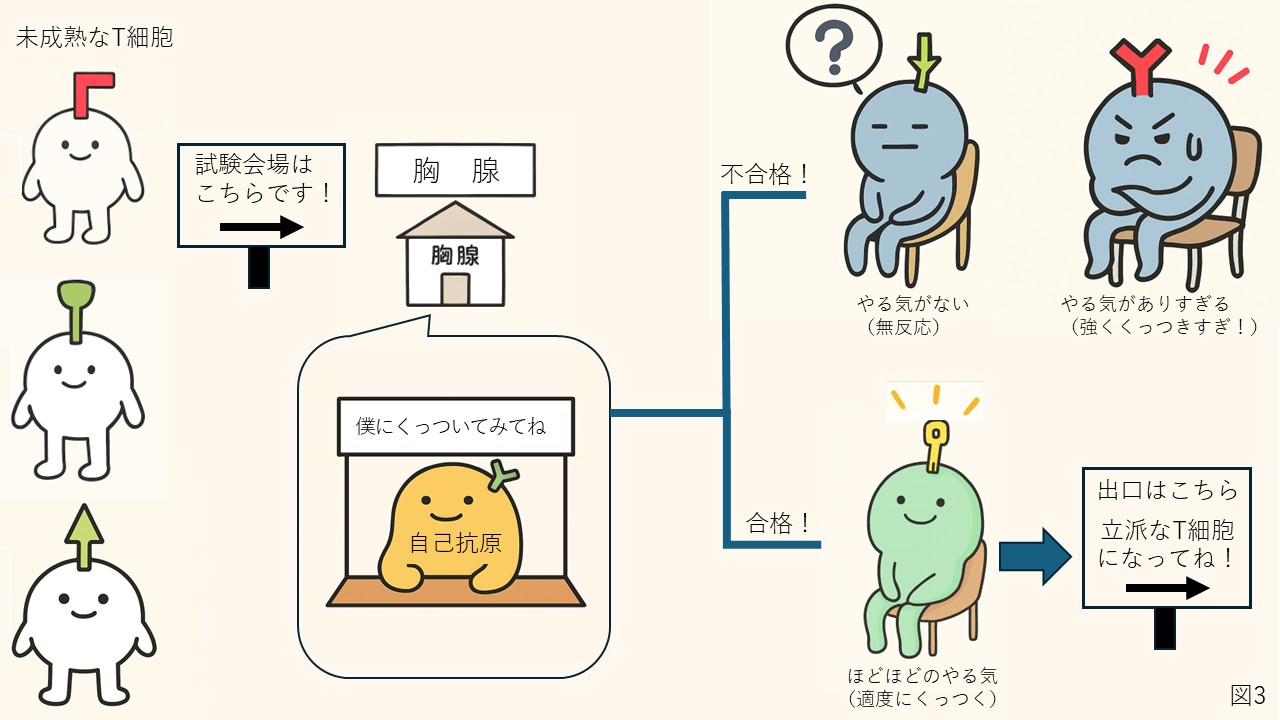
成熟前のT細胞は、胸腺で選別を受けます。胸腺はT細胞の試験会場のような場所です。未成熟なT細胞は多様な受容体を持っていますが、その中には自己抗原に強く結合する危険なものも含まれます。胸腺では自己抗原を提示して反応をチェックし、まったく反応できない細胞*は排除され、逆に強すぎる反応を示す細胞も自己に対する免疫反応を起こす危険があるため排除されます。適度に反応できる細胞だけが“合格”し、成熟して胸腺を出て免疫系で働くことができます。 *正確には、「まったく反応できない細胞」は自己抗体に反応しないというよりは、MHC(主要組織適合遺伝子複合体:しゅようそしきてきごうふくごうたい)と呼ばれる、「自分自身の目印」にも反応できない受容体を持っているという意味になります。MHCに反応しないということは「抗原提示が提示されていることに気づかない」ということになり、免疫反応の役に立たないわけです。
しかし困ったことに、この選別システムはそこまで厳密ではなく、胸腺から出てきた成熟したT細胞の中にも自分を攻撃してしまう性質をもったもの(自己攻撃性のT細胞)が混じっています。問いの答え
長々と説明してきたことをまとめると、我々の体は、無数にある多様な異物の侵入に対応できるように、異物の侵入を感知する少しずつ性質の違う「受容体」をたくさん作るため、中には自分の体を構成する成分にくっつきやすい性質の受容体もできてしまう、ということになります。そういった自分にくっつく性質の受容体を持ったT細胞が、自己攻撃性のT細胞になるわけです。これが、「なぜ免疫が自分の体を攻撃するなんてことが起こるのか?」「なぜ健康な状態の免疫システムに、自分の体を攻撃してしまうような「危険な」免疫細胞がいるのか?」という問いの答えです。
制御性T細胞が自己免疫疾患を防ぐ仕組み
胸腺で起こる前駆細胞の選別過程は、ヘルパーT細胞、キラーT細胞のどちらに分化する細胞でも起こるので、特に区別なく「T細胞」というくくりで説明しました(正確には、選別過程でヘルパーとキラーに分かれていきます)。しかし、このお話の中心である制御性T細胞がどうやってできてくるのかは気になるところですよね。他のT細胞とは分けて特に詳しく知りたいかもしれませんが、残念ながら、制御性T細胞の分化過程はまだ詳しくわかっていません。自己抗原にピッタリくっついてしまうものは排除され、ちょうど良いくっつきやすさのものは一般的な(免疫反応を促進する)ヘルパーT細胞になり、その中間の「排除されない程度に強く自己抗原につくもの」が制御性T細胞になると考えられています。
つまり、Tregは、他のヘルパーT細胞よりも自己抗原にくっつきやすい性質を持っている、ということになります。それが、Tregが免疫機能を抑制する役割にとても重要になります。
自己攻撃性のT細胞は、樹状細胞が提示する自己抗原にくっつくことによって、免疫系を活性化して、その抗原に対する攻撃性を発揮します。Tregは、一般的なT細胞よりも抗原にくっつきやすい性質を持っているので、自己抗原にもいち早くくっついて、自己攻撃性T細胞が活性化されるのを防ぐ働きをします。さらにTregは、免疫反応を落ち着かせる物質(IL-10やTGF-βなど)を出して、周りの免疫細胞の働きを弱めます(図4)。つまりTregは「先に結合して邪魔をする」だけでなく、「積極的にブレーキをかける」という2つの仕組みをつかって、自己攻撃性のT細胞が暴走しないようにしているわけです*5。
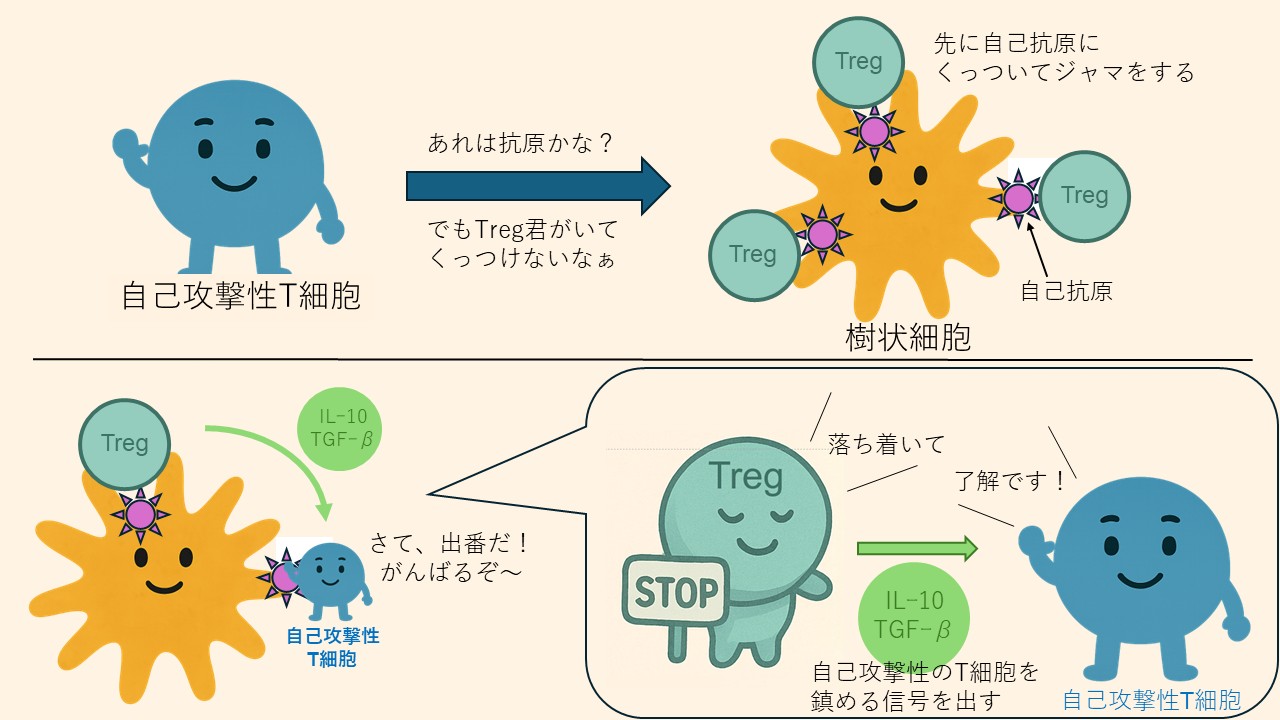
制御性T細胞(Treg)は、体を守るための「ブレーキ役」です。自己抗原に反応してしまうT細胞(自己攻撃性のT細胞)が、樹状細胞にくっついてしまうと、活性化して自分の体を攻撃し始めてしまいます。そこでTregは、自己抗原にすばやく結合して、自己攻撃性T細胞の活性化を防ぎます。さらにTregは、IL-10やTGF-βと呼ばれる免疫系を落ち着かせる物質を出して、周りの免疫細胞の働きを弱めます。Tregは二つの方法で、自己攻撃性のT細胞の働きを抑えて、自己免疫疾患が起こらないようにしています。
*5: Tregは、危険な自己攻撃性T細胞に直接接触することでも、その働きを弱めていることが分かっています。これは「細胞どうしの会話」のようなもので、Tregの細胞表面にあるたんぱく質(CTLA-4やPD-1/PD-L1など、免疫チェックポイント分子と呼ばれるもの)を使って「落ち着け」という信号を送り、自己攻撃性T細胞が暴走しないようにする仕組みです。
また、制御性T細胞は、自己免疫疾患を防ぐだけではなく、正常な免疫反応の場でも重要な役割を果たしています。免疫は、私たちの体を感染症から守ってくれていますが、過剰な免疫応答は体を壊してしまうこともあります。「炎症(えんしょう)」は免疫応答の一部であり、生体の防御と修復に不可欠な反応ですが、過剰な炎症反応は、体内の組織を損傷してしまうことがあります。Tregは、過剰な免疫応答を抑制し、組織損傷を防ぐ役割を持っていることが知られてします。Tregは感染症における免疫応答のバランスを調整し、免疫反応に伴う炎症で傷んだ組織の修復にも関与しています。Tregの臨床応用への期待
自己免疫疾患として知られるの多く疾患は治療法が確立しておらず、現在も根治が難しいものが多いです。Tregは自己免疫疾患の発症や抑制に深くかかわっており、Tregの研究には、難病に分類される疾患の治療法につながるものとして大きな期待がかけられています。また、ガン細胞についてはもともと自分自身の細胞なので、Tregがガン細胞に対する免疫反応を抑制して、結果としてガン細胞を守ってしまうことがあります。Tregの機能を上手に調節することができれば、免疫は遠慮なくガン細胞を攻撃することができるようになり、ガンを治療することができるようになると期待されています。
医療への応用の幅が大きい分、Tregの研究には大きな期待がかけられていますが、将来的に臨床応用につなげるためには、Tregによる免疫機能の抑制メカニズムの全体像を把握することが必要です。さらに研究を進める必要があります。
坂口先生の研究へのご支援をお願いいたします。
坂口先生は、現在も免疫学フロンティア研究センターでTreg細胞の研究を続けています。先生の研究は、ガン免疫療法、糖尿病や関節リウマチなどの自己免疫疾患の治療、アレルギー性疾患の治療や予防、臓器移植時の拒絶反応の抑制(免疫寛容の誘導)など多様な病気の治療につながります。坂口先生の研究活動をさらに充実させるため、ぜひとも皆さまからのご寄付をお願い申し上げます。
ノーベル賞の受賞につながった坂口先生の主要な論文
Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor a-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995:155:1151-1164.制御性T細胞の特異的分子マーカーの同定に成功し、制御性T細胞とその免疫自己寛容機能の存在を証明した。
Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003:299:1057-1061.
制御性T細胞への分化と機能の獲得を制御する転写因子としてFOXP3を同定した。
