分化制御
Lymphocyte Differentiation
TEL 06-6879-4457
FAX 06-6879-4460
概要
リンパ球の人為的制御を目的として、その基盤になる細胞の生死・分化という運命決定メカニズムの解明を目指します。
ヒトをはじめとする高等生物には、細菌やウイルスなど外界から侵入してくる異物から生体を守る免疫システムが備わっており、その根幹をなすのが抗体を産生して異物を認識し、排除するBリンパ球です。事実、Bリンパ球は多種多様な異物に対抗するため、抗体遺伝子をランダムに変化させることで対応しています。一見、合目的的に見えるこの抗体遺伝子のランダムな変化は、逆の見方をすると、ランダムな遺伝子変化ゆえに自己を攻撃する抗体を作り出し、自己免疫疾患を引き起こす危険が常につきまとっています。
Bリンパ球がどのようなメカニズムで分化・増殖し、自己を攻撃する細胞を選別、排除していき、一方異物に対して反応する細胞を、ready to goの状態に保っているかを理解することが、私たち分化制御グループの最大のテーマです。当然ながら、その先にはリンパ球の人為的制御法の開発をつうじて、アレルギー疾患・感染症・自己免疫疾患のより効率的な治療法開発への貢献を目指しています。
液性免疫応答におけるPLCg2の機能
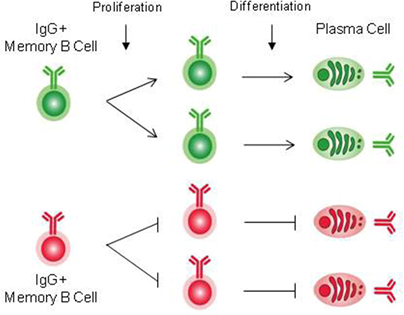
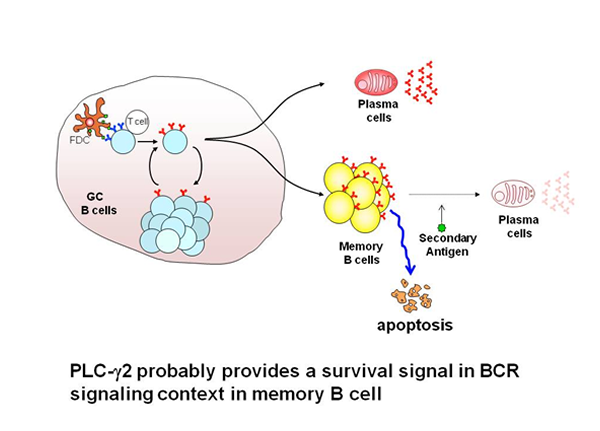
IgG抗体を主とする二次抗体産生応答(既往反応)は周知のように迅速かつ高親和性の特異抗体が多量に産生されることがその特徴です。一般的に既往反応を惹起する抗原特異的B細胞は、一次応答時に抗原特異的B細胞クローンが増殖した後に、メモリーB細胞プールとして維持されていると考えられており、ほとんどのメモリーB細胞は胚中心(germinal center:GC)における応答が起源であるとされています。GCにおいては、Ig可変部の突然変異とこれに応じた抗原特異的BCRの親和性に基づく「選択」の両プロセスが高親和性抗体産生の要因となり、最終的に長寿命プラズマ細胞もしくは長寿命メモリーB細胞へと分化します。GCにおける応答に際して生成される抗原特異的B細胞はナイーブB細胞とは異なる固有の特徴を獲得すると考えられ、このため二次抗体産生応答における迅速かつ多量の抗体が産生されます。従って、メモリーB細胞がどのように生成され、かつ維持されるのか、またナイーブB細胞とメモリーB細胞に見られる機能的な差異はいかなるものか、などは免疫記憶の基盤を解明するに通ずる極めて興味ある課題と言えます。メモリーB細胞の生成と維持にBCR由来のシグナルが必要であるかを明らかにするため、我々は、BCRシグナル経路の重要な因子であるPLCg2着目し、生存シグナルの伝達を通じてPLCg2がメモリーB細胞の効率的な生成と維持に必須であることを明らかにしました。
カルシウム調節機構
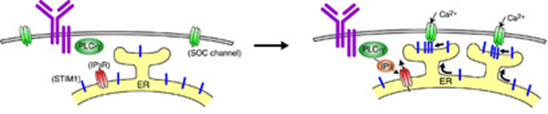
カルシウムが様々な生理的現象において極めて重要な役割を担っていることは広く知られています。外部刺激によって誘導される細胞内カルシウムの上昇は主に二つの経路から供給され,一つは細胞内カルシウム貯蔵庫(ストア)である小胞体からのカルシウム放出、もう一つは細胞膜上のカルシウムチャネルを介した細胞外からのカルシウム流入です。刺激により活性化されたホスホリパーゼC (PLC) が産生するイノシトール3リン酸(IP3)が小胞体上のIP3レセプターに結合すると、迅速かつ一過性に小胞体から細胞質にカルシウムが放出されます。その後、この小胞体ストア内のカルシウム減少(枯渇)そのものが引き金となって、細胞外から細胞内にカルシウムが流入してきます。これをストア作動性カルシウム(store-operated calcium;SOC)流入とよびます。SOC流入は細胞内の持続的なカルシウム上昇を維持する上で重要であると考えられていましたが、細胞内カルシウムストアの枯渇が、どのような分子メカニズムで細胞膜チャネルを開口させるのかは、長年不明でありました。しかし、2005年に小胞体カルシウムセンサーとしてSTIM1が同定され、小胞体に局在するSTIM1がカルシウム枯渇により、SOCチャネルを活性化する分子であることがわかりました。我々のB細胞株を用いた研究から、B細胞レセプター刺激によりSTIM1は細胞膜直下の小胞体のサブコンパートメントに集積し、SOC流入を開始させることがわかりました。
我々はSOC流入の個体レベルでの生理的役割を解析するために、STIM1欠損マウスを作製しました。STIM1を全身で欠失させるようなマウスは分娩前後で致死となり、発生過程においてSTIM1が重要な役割を果たす事が示唆されました。次に、肥満細胞におけるSOC流入の役割の解析へと発展させました。まず、STIM1が肥満細胞のSOC流入に必要であるのかを検討したところ、STIM1欠損肥満細胞ではFcεRI刺激によるカルシウム流入が著減していることがわかりました。STIM1欠損肥満細胞の脱顆粒を野生型と比較したところ、STIM1欠損肥満細胞はほとんど脱顆粒を起こさない事が分かりました。すなわち、脱顆粒を誘導するには小胞体からのカルシウムでは不十分で、STIM1依存的カルシウム流入が必要であることを示しています。抗原刺激により産生されるIL-6, TNF, IL-13を調べたところ、STIM1欠損により、これらの分泌が抑制されており、STIM1がサイトカイン産生に重要な役割を担っている事もわかりました。さらに、STIM1依存的カルシウムシグナルの下流でNF-κB,NFATが活性化されることも明らかにし、これら分子がサイトカイン産生を制御することが示唆されました。肥満細胞は個体レベルでのアレルギー反応発症に必須の細胞であることから、STIM1の関与を検討したところ、in vivoでのアレルギー反応にもSTIM1が大きく貢献していることを突き止めました。
B細胞でのRas/Erkシグナルの機能
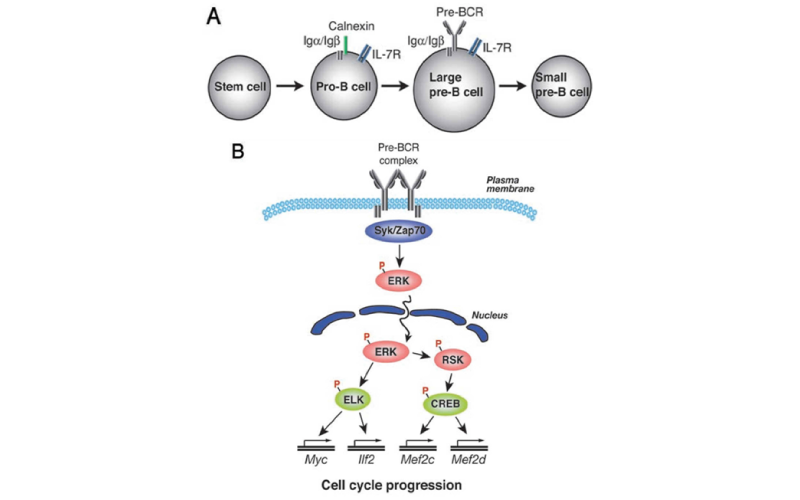
Rasの活性化には、二種類のRas活性化因子、RasGRPファミリーとSosファミリーの存在が指摘されています。私たちはBCRによるRas活性化にはRasGRPファミリーの内、特にRasGRP3が要求されることを明らかにしました。RasGRP3はPLCg2活性化によって産生されるDAGにより細胞質から細胞膜にリクルートされ、その後RasGRP3の133番目に存在するThrがリン酸かされることが重要であることを明らかにしました。
Ras活性化による下流のシグナルとしてはErk活性化がもっともよく知られています。しかしながら、B細胞分化・活性化におけるErkの機能は不明のままでありました。Erkには2つの遺伝子Erk1, Erk2と存在しますが、B細胞特異的にErk2を欠損したマウスを用いて、IgG1にクラススイッチした外来抗原特異的B細胞の生存に必須であることが明らかになりました。更にErk1, Erk2共に欠損したB細胞では、発生初期のB細胞の分化の障害が認められた。Pre-BCRを介するpro/preB細胞の増殖にErk1/Erk2が必須であること、更に、このErk1/Erk2が転写因子Elk1, CREBをリン酸化することにより、この発生段階での増殖に必須の遺伝子、例えばc-Mycを転写レベルで制御することにより、増殖を司っていることが判明しました。
メンバー
- 黒崎 知博 招へい教授
kurosakiifrec.osaka-u.ac.jp - 井上 毅 招へい教授
inoueifrec.osaka-u.ac.jp
業績
論文
- Inoue, T., Morita, M., Hijikata, A., Fukuda-Yuzawa, Y., Adachi, S., Isono, K., Ikawa, T., Kawamoto, H., Koseki, H., Natsume, T., Fukao, T., Ohara, O., Yamamoto, T., Kurosaki, T.
CNOT3 contributes to early B cell development by controlling Igh rearrangement and p53 mRNA stability.
J. Exp. Med. pii: jem.20150384 - Onishi, M., Ozasa, K., Kobiyama, K., Ohata, K., Kitano, M., Taniguchi, K., Homma, T., Kobayashi, M., Sato, A., Katakai, Y., Yasutomi, Y., Wijaya, E., Igarashi, Y., Nakatsu, N., Ise, W., Inoue, T., Yamada, H., Vandenbon, A., Standley, D.M., Kurosaki, T., Coban, C., Aoshi, T., Kuroda, E., Ishii, K.J.
Hydroxypropyl-β-cyclodextrin spikes local inflammation that induces Th2 cell and T follicular helper cell responses to the coadministered antigen.
J Immunol. 15;194:2673-82. - Uebelhart, R., Hug, E., Bach, MP., Wossning, T., Duhren-von Minden, M., Horn, AHC., Kometani, K., Kurosaki, T., Sticht, H., Reth, M., Jumaa, H.
Responsiveness of B cells is regulated by the hinge region of IgD.
Nat Immunol. 16:534-43. 2015 - Baba, Y., Matsumoto, M., Kurosaki, T.
Signals controlling the development and activity of regulatory B-lineage cells.
Int. Immunol. pii: dxv027 - Kurosaki, T., Kometani, K., Ise, W.
Memory B cells.
Nat Rev Immunol. 15:149-59. 2015 - Kometani, K., Kurosaki, T.
Differentiation and maintenance of long-lived plasma cells.
Curr Opin Immunol.33C:64-69. 2015 - Uebelhart, R., Hug, E., Bach, MP., Wossning, T., Duhren-von Minden, M., Horn, AHC., Kometani, K., Kurosaki, T., Sticht, H., Reth, M., Jumaa, H. Structural Differences between IgD and IgM control B cell tolerance and the generation of innate-like B1 cells.
Nat. Immunol. in press - Baba, Y., Matsumoto, M., Kurosaki, T.
Calcium signaling in B cells: regulation of cytosolic Ca2+ increase and its sensor molecules, STIM1 and STIM2.
Mol Immunol.62:339-43. 2014 - Wing, J.B, Ise, W., Kurosaki, T., Sakaguchi, S.
Regulatory T Cells Control Antigen-Specific Expansion of Tfh Cell Number and Humoral Immune Responses via the Coreceptor CTLA-4.
Immunity41:1013-25. 2014 - Tanaka, S., Tanaka, K., Magnusson, F., Chung, Y., Martinez, G.J., Wang, Y.H., Nurieva, R.I., Kurosaki, T., Dong, C.
CCAAT/Enhancer-Binding Protein α Negatively Regulates IFN-g Expression in T Cells.
J Immunol. 193:6152-60 - Hendron, E., Wang, X., Zhou, Y., Cai, X., Goto, J.I., Mikoshiba, K., Baba, Y.,Kurosaki, T., Wang, Y., Gill, D.L.
The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program.
Cell Calcium. 56:482-492. - Itoh-Nakadai, A., Hikota, R., Muto, A., Kometani, K., Watanabe-Matsui, M., Sato, Y., Kobayashi, M., Nakamura, A., Miura, Y., Yano, Y., Tashiro, S., Sun, J., Ikawa. T., Ochiai, K., Kurosaki, T., Igarashi, K.
The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program.
Nat Immunol. 15:1171-80. - Matsumoto, M., Baba, A., Yokota, T., Nishikawa, H., Ohkawa, Y., Kayama, H., Kallies, A., Nutt, S.L., Sakaguchi, S., Takeda, K., Kurosaki, T., Baba, Y.
Interleukin-10-Producing Plasmablasts Exert Regulatory Function in Autoimmune Inflammation.
Immunity 41:1040-51 - Schimmack, G., Eitelhuber, A.C., Vincendeau, M., Demski, K., Shinohara, H., Kurosaki, T., Krappmann, D.
AIP augments CARMA1-BCL10-MALT1 complex formation to facilitate NF-κB signaling upon T cell activation.
Cell Commun Signal. 12:49 111:11792-7 - Ise, W., Inoue, T., McLachlan, J.B., Kometani, K., Kubo, M., Okada, T.Kurosaki, T.
Memory B cells contribute to rapid Bcl6 expression by memory TFHcells.
Proc. Natl. Acad. U.S.A. 111:11792-7 - Furukawa, Y., Teraguchi, S., Ikegami, T., Dagliyan, O., Jin, L., Hall, D., Dokholyan, N.V., Namba, K., Akira, S., Kurosaki, T., Baba, Y., Standley, D.M.
Intrinsic disorder mediates cooperative signal transduction in STIM1.
J Mol Biol. 426:2082-97, 2014 - Shinohara, H., Behar, M., Inoue, K., Hiroshima, M., Yasuda, T., Nagashima, T., Kimura, S., Sanjo, H., Maeda, S., Yumoto, N., Ki, Sewon, Akira, S., Sako, Y., *Hoffmann, A., *Kurosaki, T., *Okada-Hatakeyama, M. (*co-corresponding authors)
Positive Feedback Within a Kinase Signaling Complex Functions as a Switch Mechanism for NF-κB Activation.
Science 344:760-764, 2014 - Hartmann. J., Karl, R.M., Alexander, R.P., Adelsberger, H., Brill, M.S., Ruhlmann, C., Ansel, A., Sakimura, K., Baba. Y., Kurosaki, T., Misgeld, T., Konnerth, A.
STIM1 Controls Neuronal Ca2+ Signaling, mGluR1-Dependent Synaptic Transmission, and Cerebellar Motor Behavior.
Neuron. 82:635-44, 2014 - Yasukawa. S., Miyazaki, Y., Yoshii, C., Nakaya, M., Ozaki, N., Toda, S., Kuroda, E., Ishibashi, K., Yasuda, T., Natsuaki, Y., Mi-ichi, F., Iizasa, E., Nakahara, T., Yamazaki, M., Kabashima, K., Iwakura, Y., Takai, T., Saito, T., Kurosaki, T., Malissen, B., Ohno, N., Furue, M., Yoshida, H., and Hara, H.
An ITAM-Syk-CARD9 signaling axis triggers contact hypersensitivity by stimulating IL-1 production in dendritic cells.
Nature Comm. 5:3755, 2014 - Masahata, K., Umemoto, E., Kayama, H., Kotani, M., Nakamura, S., Kurakawa, T., Kikuta, J., Gotoh, K., Motooka, D., Sato, S., Higuchi, T., Baba, Y., Kurosaki, T., Kinoshita, M., Shimada, Y., Kimura, T., Okumura, R., Takeda, A., Tajima, M., Yoshie, O., Fukuzawa, M., Kiyono, H., Fagarasan, S., Iida, T., Ishii, M., Takeda, K.
Generation of colonic IgA-secreting cells in the cecal patch.
Nature Comm. 5:3704, 2014 - Kuwahara, M., Suzuki, J., Tofukuji, S., Yamada, T., Kanoh, M., Matsumoto, A., Maruyama, S., Kometani, K., Kurosaki, T., Ohara, O., Nakayama, T., Yamashita, M.
The Menin-Bach2 axis is critical for regulating CD4 T cell senescence and cytokine homeostasis.
Nature Comm. 5:3555, 2014 - Zhang, H., Clemens, R.A., Liu, F., Hu, Y., Baba, Y., Theodore, P., Kurosaki, T., and Lowell, C.A.
The STIM1 calcium sensor is required for activation of the phagocyte oxidase during inflammation and host defense.
Blood 123:2238-49, 2014 - Lorès P, Vernet N, Kurosaki T, Van de Putte T, Huylebroeck D, Hikida M, Gacon G, Tourè A.
The STIM1 calcium sensor is required for activation of the phagocyte oxidase during inflammation and host defense.
Dev Biol.386, 419-427, 2014 - Capietto, A.H., Kim, S., Sanford, D.E., Liehan, D.C., Hikida, M., Kurosaki, T., Novack, D.V. and Faccio, R.
Downregulation of PLCgamma2-beta-catenin pathway promotes activation and expansion of myeloid-derived suppressor cells in cancer.
J. Exp. Med. 210, 2257-2271, 2013 - Sasaki, Y., Sano, S., Nakahara, M., Murata, S., Kometani, K., Aiba, Y., Sakamoto, S., Watanabe, Y., Tanaka, K., Kurosaki, T., and Iwai, K.
Defective immune responses in mice lacking LUBAC-mediated linear ubiquitination in B cells.
EMBO J. 32, 2463-76, 2013 - Dieterle, A.M., Bohler, P., Keppeler, H., Alers, S., Berleth, N., Driesen, S., Hieke, N., Pietkiewicz, S., Loffler, A.S., Peter, C., Gray, A., Leslie, N.R., Shinohara, H., Kurosaki, T., Engelke, M., Wienands, J., Bonin, M., Wesselborg, S., and Stork, B.
PDK1 controls upstream PI3K expression and PIP3 generation.
Oncogene 2013 - Kometani, K., Nakagawa, R., Shinnakasu, R., Kaji, T., Rybouchkin, A., Moriyama, S., Furukawa, K., Koseki, H., Takemori, T. and Kurosaki, T.
Repression of the Transcription Factor Bach2 Contributes to Predisposition of IgG1 Memory B Cells toward Plasma Cell Differentiation.
Immunity 39, 136-147, 2013 - Tsukumo, S., Unno, M., Muto, A., Takeuchi, A., Kometani, K., Kurosaki, T., Igarashi, K., Saito, T.
Bach2 maintains T cells in a naive state by suppressing effector memory-related genes.
Proc. Natl. Acad. Sci. U.S.A. 110:10735-40, 2013
