1細胞1分子
イメージング
Single Molecule Imaging
TEL 06-6879-4630
FAX 06-6879-4634
概要
生体内では、様々な蛋白質が、生体素子として機能している。これらの蛋白質が、細胞内情報処理分子システムを構築し、細胞は複雑で柔軟な活動を行っている。本研究室の研究目的は、免疫反応における、情報伝達の分子機構の解明である。蛋白質を介した細胞内の情報伝達反応はきわめて少ない分子数によって担われていると考えられている。さらに、細胞内の構造や環境は不均一である。従って、上記目的を達成する為に、本研究室では、生きている細胞中で、蛋白質1分子の時空間ダイナミクスを直接観察するための、顕微鏡技術の開発を行う。現在、我々が所有する顕微鏡技術を以下に紹介する。
1) エバネッセント蛍光顕微鏡による細胞情報伝達の1分子イメージング
本研究室では、これまでに近接場を用いた、エバネッセント1分子蛍光顕微鏡を開発してきた。近接場による照明では、レーザーをカバーガラス表面で全反射させるように対物レンズ内に入射することによって、観察試料のわずか数百ナノメートルのみを照射することが可能となる。この照射方法を用いることによって、従来の蛍光顕微鏡に比べて、背景光を1/2000まで軽減することが可能となり、非常にコントラストの良い蛍光画像を取得することができ、蛍光色素1分子の像を捕らえることが可能である。 上記技術の細胞生物学・医学研究へと応用の一つとして、生きた細胞の中で生体1分子のイメージングを挙げる。生理活性物質リガンドが細胞へ結合する様子や情報伝達分子の二量体化、複合体形成、リン酸化、拡散、構造変化などの細胞内シグナル伝達の素過程を生きた細胞内で1分子レベルで可視化することが可能である(図1)。電子顕微鏡を用いた観察では、細胞を生きたまま観察することが出来ないが、細胞内1分子イメージング法では、生きた細胞内で分子本来の挙動を分子1個ずつ観察することができる。
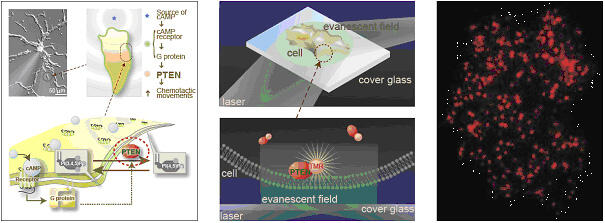
白血球や細胞性粘菌などの細胞の走化性に関与する PTEN 分子を細胞内で1分子イメージングした。(右)赤い輝点が細胞膜に結合した PTEN 1分子である。
2) 細胞内における蛋白質のナノメートル計測
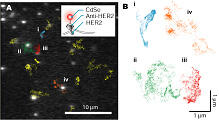
標的の蛋白質に蛍光色素を結合させる、あるいは、蛍光蛋白質を融合させ、その蛍光輝点の重心位置を計算すれば、生きた細胞内において蛋白質1分子の運動を追跡する事ができる。蛋白質1分子の運動を追跡する位置精度は、蛍光強度が十分に高ければ約2nmにまで達する。
膜蛋白質HER2(Human EGF Receptor 2)を抗体を介して蛍光性量子ドットで蛍光標識し、その運動を追跡した(図2A)。細胞膜で、膜蛋白質が拡散運動をする事が知られているが、細胞の何かしらの構造を反映した運動を行っている事が明らかになった(図2B)。
細胞内でのナノメートル計測は、これまでに観察することのできなかった、蛋白質の「生の」運動を観察する事ができる。
3) 蛍光粒子の3次元ナノ計測
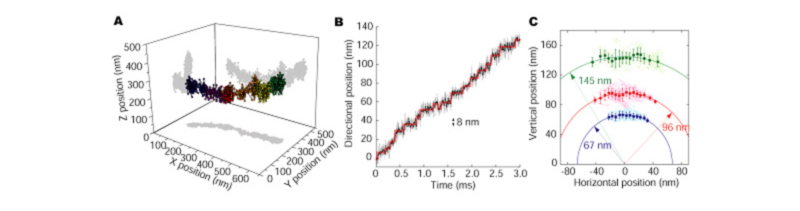
我々は、蛍光粒子の運動を三次元的に追跡するために、二つの異なる焦点面の画像を一つの画像処理装置で取得できる光学系を構築した(二焦点分岐光学)。二焦点分岐光学を用いた三次元粒子追跡法の原理は、至って単純である。二つの焦点面の間にある蛍光粒子の像は、両方の焦点面に映り込む。その両方の像の蛍光強度やぼけは、粒子の垂直方向の位置と相関する。我々は、異なる二つの焦点で得られた蛍光像の蛍光強度を指標として、粒子の垂直方向の位置を計算するアルゴリズムを完成させた。
二焦点分岐光学を用いて、モーター蛋白質ダイニンによって輸送されている小胞を、細胞内で三次元的に追跡した(図1A)。小胞の進行方向を座標軸に見てみると,小胞が8nm毎の階段状に運動している事が明らかになった(図3B)。次は、小胞が輸送される様子を真正面から覗いてみた(図3C)。小胞は、円柱上に左右に揺れながら前に輸送されていたのである。この円柱の半径は、109nmと見積もられ、微小管の中心からモーター蛋白質ダイニンの小胞結合部位までの長さとほぼ一致する。上記の光学と解析方法を用いれば、細胞内で動いている蛋白質の動きが、そのまま観察できるのである。
4)二光子顕微鏡慢性観察用の鼠径部ウィンドーの開発
二光子顕微鏡は非線形光学現象を応用し、2つの長波長光子(800nm 以上)を同時に吸収させることで蛍光励起を行うレーザー走査型顕微鏡である。この励起方法により、他の光学顕微鏡に比較して、組織への光傷害を抑えつつ、深部への照射が行え、生きた個体、臓器中の細胞動態のリアルタイム解析を可能とする。
現在、二光子顕微鏡は生きた個体での細胞動態を明らかとする唯一の手法であるが、超音波や磁気共鳴を用いる画像解析法より適用性で劣る。最大の理由は侵襲性で、視野を遮る皮膚や脂肪などを外科的に除去し、観察対象の臓器を露出する必要がある。その結果として、二光子顕微鏡で数百μm程度の深さまでのリンパ臓器内の細胞を可視化できるが、侵襲的な外科処置は一個体の繰り返し観察、及び、病態の発達期間に渡っての慢性観察を困難とする。
二光子顕微鏡の、この適用性の短所を克服するために、本研究室ではマウスの鼠径リンパ節の長期観察用の移植ウィンドーを開発し、系の有用性をホメオスタシス増殖時のT細胞の移動と増殖過程を2週間に渡り観察することで示した。
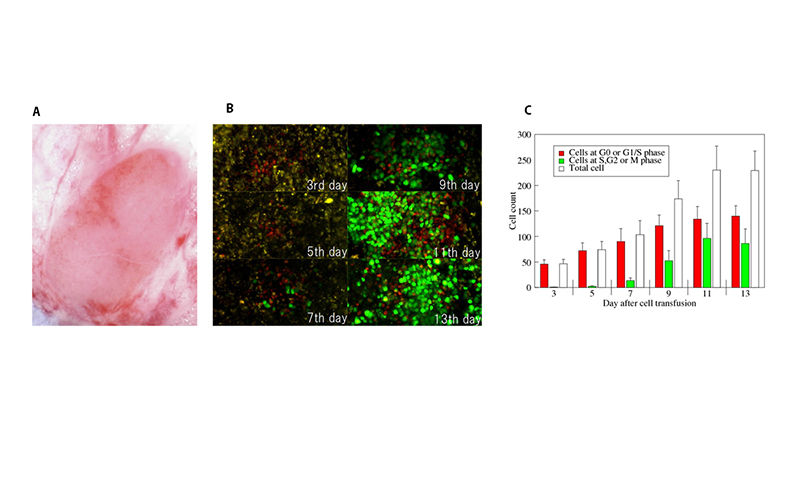
(A)観察ウィンドー中の鼠径リンパ節。(B)同一部位、同一個体を画像化した処置後3-13日のT細胞の二光子顕微鏡像。(C)画像から定量化したT細胞の増殖過程。
主任研究者
柳田 敏雄 教授

研究内容
1分子イメージング、ナノ計測、顕微鏡開発
学歴
| 1969 | 大阪大学 基礎工学部 電気工学科 大学 卒業 |
|---|---|
| 1971 | 大阪大学 基礎工学研究科 電気工学系専攻 修士 修了 |
| 1974 | 大阪大学 基礎工学研究科 生物工学系専攻 博士 中退 |
| 1976 | 大阪大学 工学博士取得 |
職歴
| 1988.4 | 大阪大学大学院基礎工学部生物工学科文部教官教授 |
|---|---|
| 1996.5 | 大阪大学医学部医学科第一生理学文部教官教授併任 |
| 2002.4 | 大阪大学大学院生命機能研究科研究科長(2004年3月まで) |
| 2002.4 | 大阪大学大学院医学系研究科 教授(兼任)(2010年3月まで) |
| 2002.4 | 大阪大学大学院生命機能研究科ナノ生体科学教授(2010年3月まで) |
| 2007.10 | 世界トップレベル研究拠点(WPI)大阪大学 免疫学フロンティア研究センター 副拠点長(2017年3月まで) |
| 2010.4 | 大阪大学大学院生命機能研究科特任教授(~現在に至る) |
| 2011.4 | 理化学研究所 生命システム研究センター長 |
| 2011.4 | 情報通信研究機構/大阪大学 脳情報通信融合研究センター長 |
| 2016.4 | 大阪大学大学院情報科学研究科特任教授 |
| 2016.4 | NECブレインインスパイヤードコンピューティング協働研究所 所長 |
受賞・表彰
| 1989.10 | 第7回大阪科学賞(大阪府、大阪市) |
|---|---|
| 1990.5 | 第4回塚原仲晃記念賞(ブレインサイエンス振興財団) |
| 1992.8 | 第1回Matsubara Lecture Award(Gordon Conference) |
| 1994.3 | 第25回内藤記念科学振興賞(内藤記念振興財団) |
| 1998.4 | 日本学士院賞 恩賜賞 (日本学士院) |
| 1999.1 | 朝日賞 (朝日新聞社) |
| 2000.10 | The Fred Fay Lecture Award (U. Mass) |
| 2003.9 | 日本神経回路学会研究賞「視覚的意識の交替を引き起こす離散的確率ダイナミクスと脳内ネットワーク」(共同受賞) |
| 2010.9 | The US Genomic Award for Outstanding Investigator in the Field of Single Molecule Biology (US Biophysical Society) |
| 2011.7 | Fellow of the US Biophysical Society (US Biophysical Society) |
| 2013.10 | 文化功労者 |
| 2017.4 | 大阪大学栄誉教授 |
メンバー
-
柳田 敏雄 教授
yanagidafbs.osaka-u.ac.jp
業績
論文
-
Chiu, L.D., Ichimura, T., Sekiya, T., Machiyama, H., Watanabe, T., Fujita, H., Ozawa, T., & Fujita, K. Protein expression guided chemical profiling of living cells by the simultaneous observation of Raman scattering and anti-Stokes fluorescence emission. Sci. Rep. 7, 43569 (2017).
-
Furusawa C., Yamaguchi T. Robust and accurate discrimination of self/non-self antigen presentations by regulatory T cell suppression. PLoS One. 11(9):e0163134 (2016).
-
Ichimura, T., Chiu, L.D., Fujita, K., Machiyama, H., Yamaguchi, T., Watanabe, T.M., & Fujita, H. Non-label immune cell state prediction using Raman spectroscopy. Sci. Rep. 6, 37562 (2016).
-
Iwaki M., Wickham S., Ikezaki K., Yanagida T., Shih W. A programmable DNA origami nanospring that reveals force-induced adjacent binding of myosin VI heads. Nature Comm. 12;7:13715 (2016).
-
Fujita K., Iwaki M., Yanagida T. Transcriptional bursting is intrinsically caused by interplay between RNA polymerases on DNA. Nature Comm. 7;7:13788 (2016).
-
Morikawa T.J., Fujita H., Kitamura A., Horio T., Yamamoto J., Kinjo M., Sasaki A., Machiyama H., Yoshizawa K., Ichimura T., Imada K., Nagai T., Watanabe T.M. Dependence of fluorescent protein brightness on protein concentration in solution and enhancement of it. Sci. Rep., 6: 22342 (2016)
-
Iwaki M, Iwane A., Ikezaki K., Yanagida T. Local heat activation of single myosins based on optical trapping of gold nanoparticles. Nano Letters, 15, 2456-2461 (2015)
-
Machiyama H., Yamaguchi T., Sawada Y., Watanabe T.M., Fujita H. SH3 domain of c-Src governs its dynamics at focal adhesions and the cell membrane. FEBS J., 282(20) 4034-4055 (2015)
-
Ichimura T., Chiu L.D., Fujita K., Machiyama H., Kawata S., Watanabe T.M., Fujita H. Visualizing the appearance and disappearance of the attractor of differentiation using Raman spectral imaging. Sci. Rep., 5: 11358 (2015)
-
Karagiannis P., Ishii Y., Yanagida T. Molecular machines like myosin use randomness to behave predictably. Chem. Rev., 114 (6), pp 3318–3334 (2014)
-
Ichimura T., Chiu L.D., Fujita K., Kawata S., Watanabe T.M., Yanagida T., Fujita H. Visualizing cell state transition using Raman spectroscopy. PLoS One, 9(1) e84478 (2014)
-
Ikezaki K., Komori T., Yanagida T. Spontaneous detachment of the leading head contributes to myosin VI backward steps. PLoS One., 8(3):e58912 (2013)
-
Fujita K., Iwaki M., Iwane A. H., Marcucci L., Yanagida T. Switching of myosin-V motion between the lever-arm swing and Brownian search-and-catch. Nat. Commun., 17;3:956 (2012)
-
Morimatsu M., Togashi Y., Nishikawa S., Sugawa M., Iwane A., Yanagida T. Spontaneous structural changes in actin regulate G-F transformation. PLoS One, 7(11) e45864 (2012)
-
Ikezaki K., Komori T., Sugawa M., Arai Y., Nishikawa S., Iwane A. H., Yanagida T. Simultaneous observation of the lever arm and head explains myosin VI dual function. Small, 8(19):3035-40 (2012)
-
Ohmachi M., Komori Y., Iwane A.H., Fujii F., Jin T., Yanagida T. Fluorescence microscopy for simultaneous observation of 3D orientation and movement and its application to quantum rod-tagged myosin V. Proc Natl Acad Sci USA, 109(14):4294-8 (2012)
-
Matsuoka S., Miyanaga Y., Yanagida T., Ueda M. Visualizing single molecules in living Dictyostelium cells using total internal reflection fluorescent microscopy (TIRFM). Cold Spring Harb Protoc. 2012(3):349-51 (2012)
-
Watanabe T.M., Tsukasaki Y., Fujita H., Ichimura T., Saitoh T., Akira S., Yanagida T. Distinct modulated pupil function system for real-time imaging of living cells. PLoS One., 7(9):e44028 (2012)
-
Nishikawa S., Arimoto I., Ikezaki K., Sugawa M., Ueno H., Komori T., Iwane A.H., Yanagida T. Switch between large hand-over-hand and small inchworm-like steps in myosin VI. Cell, 142, 879-88 (2010)
-
Fujii T., Iwane A.H, Yanagida T., Namba K. Direct visualization of secondary structures of F-actin by electron cryomicroscopy. Nature, 467, 724-8 (2010)他300篇
その他
[国 内]
日本生物物理学会(2002年~2003年度 会長)
日本生理学会
日本物理学会
新技術事業団柳田生体運動子プロジェクト総括責任者(1992年10月~1997年9月)
新技術事業団1分子過程プロジェクト総括責任者(1998年1月~2002年12月)
独立行政法人情報通信研究機構柳田結集型特別グループリーダー(1998年4月~2003年3月)
文科省21世紀COE 拠点リーダー(2002年10月~2007年3月)
戦略創造「ソフトナノマシンプロジェクト」研究代表者(2002年11月~2007年9月)
戦略創造「生命現象の解明と応用に資する新しい計測・分析・基盤技術」研究総括(2004年7月~2012年3月)
日本学術会議会員(2005年~)
文科省グローバルCOE 拠点リーダー(2007年10月~2012年3月)
自然科学研究機構分子研究所研究顧問(2011年2月~)
理化学研究所HPCI計算生命科学推進プログラム プログラムディレクター(2011年4月~2016年3月)
[国 外]
米国生物物理学会(2006年~2010年 評議員)
ヒューマンフロンティア(HFSP)科学者会議副議長(2004年~2006年)
