News & Topics
遺伝子(DNA)ワクチンの作用機序を解明 (審良拠点長・石井准教授らが Nature に掲載)
遺伝子(DNA)ワクチンの作用機序を解明(DNAワクチンの本格開発にはずみ)
審良静男(大阪大学免疫学フロンティア研究センター拠点長)、石井健(同センター准教授)らは、「DNAワクチン」とよばれる新型ワクチンの作用メカニズムを明らかにしました。 DNAワクチンとは、エイズやインフルエンザなどの感染症、がん、アレルギー、アルツハイマーなどの疾患に対して開発の進んでいる次世代のワクチンですが、その免疫学的な作用メカニズムはまだよく分かっていません。特に生体に投与されたDNAがどのように免疫システムに作用して、DNAワクチンの効果=抗原に対する免疫反応:獲得免疫注1)=を誘導しているかは不明でした。
研究チームは今回、DNAの右巻きの二重らせん構造(B-DNA)注2)が細胞内でTank-Binding Kinase 1 (TBK1)注3)という酵素(シグナル伝達分子)を介して自然免疫系注4)を活性化することでワクチンの内因性アジュバント注5)として作用し、自然免疫系活性化のシグナルがDNAワクチンの効果発現に必須であることを突き止めました。また、DNAワクチンの効果のうち、抗体の産生のためには樹状細胞などの免疫細胞でのTBK1依存性の自然免疫活性化が重要で、T細胞による細胞性免疫の活性化のためにはDNAを取り込んだ筋肉細胞などの非免疫細胞でのTBK1の活性化が重要であることも判明しました。
DNAが免疫システムによってどのように認識されるのかなどを生体レベルで明らかにした今回の成果は、上記疾患などに対するDNAワクチンの開発に大きく貢献するとともに、DNAを基盤とした免疫療法や遺伝子治療の機序解明・進展に寄与するものと期待されます。
本研究は、JSTのEARATO審良自然免疫プロジェクトの一環として行われ、この論文は、2008年2月7日(英国時間)発行の英国科学雑誌「Nature」に掲載されました。
<研究の背景>
ワクチンは現存する医療技術の中で、その起源が最も古く、かつ有効なもののひとつです。近年の免疫学の発展と、遺伝子組み換え技術や化学合成などの技術革新によって、より戦略的なワクチン設計が可能になってきています。
その中で注目を浴びている新型のワクチンとして、DNAワクチンと呼ばれるものがあります。DNAワクチンとは、プラスミドDNAと呼ばれる細菌由来の環状DNAに抗原を発現する遺伝子を組み込んだもので、生体に投与すると、その抗原に特異的な免疫反応を誘導します。従来のワクチンに比べて、製法が簡便でコストも抑えられるため、各種感染症やがん、アレルギー疾患などに対する新たなワクチンとして広く研究され、その臨床応用が世界レベルで進んでいます。ヒトではまだ認可されたものはありませんが、動物用ワクチンとしてウマの西ナイルウイルス感染症、養殖サケのウイルス感染症、ペット犬の悪性黒色腫(メラノーマ)に対するDNAワクチンが北米で認可され、実際に使用されています。
しかしその一方で、DNAワクチンがなぜ効くのかという、免疫学的な作用メカニズムの解明はあまり進んでいません。特にDNAワクチンが持つアジュバント効果に関しては、ワクチンのプラスミドDNAに存在するCpGモチーフ注6)という特殊な配列がトル様(よう)受容体9(Toll-like receptor 9, TLR9)注7)によって認識されることで起こる自然免疫系の活性化によるものと思われていました(図1)。
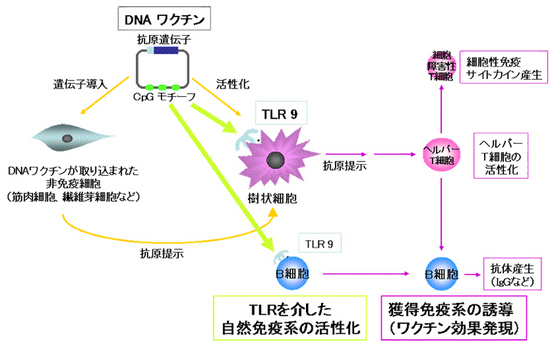
図1 今まで考えられていたDNAワクチンの作用機序
ワクチンのプラスミドDNAに存在するCpGモチーフという特殊な配列がトル様(よう)受容体9(Toll-like receptor 9, TLR9)によって認識されることで自然免疫系の活性化が起こると考えられていました。
しかし最近、いくつかの研究グループによってTLR9を介した自然免疫反応はDNAワクチンの効果に無関係であるということが示されました。DNAワクチンの免疫学的、生理学的な作用メカニズムを詳細に解明することは、より効果的なワクチンの開発のみならず、副作用の予防などにも役に立つと期待されており、そのメカニズム解明が望まれています。
<研究内容>
今回、TLR9を始めとする自然免疫系に関連する分子の遺伝子欠損マウス注8)を作製し、自然免疫系の担う役割を示すとともに、DNAワクチンの作用メカニズムを明らかにしました。
本研究において研究チームはまず、TLRとTLRに関連するシグナル分子の遺伝子を欠損したマウスにDNAワクチンを投与し、その効果を調べました。すると、それらのマウスでは、野生型マウスと同程度の獲得免疫系の誘導が見られました。すなわち、ワクチンの効果発現には、TLRの関与が非常に低いことが分かりました。ところが、I型インターフェロン注9)の受容体遺伝子を欠損したマウスの場合には、DNAワクチンの効果は顕著に低下しました。つまり、DNAワクチンの効果には、TLRを介さずにI型インターフェロンを誘導する経路が存在することが判明したのです。
一方で、研究チームは最近、B-DNAがTLRを介さずに、TBK1というシグナル伝達分子(酵素)を介し、炎症性サイトカイン注10)やI型インターフェロンを産生することを発見しています(図2)。
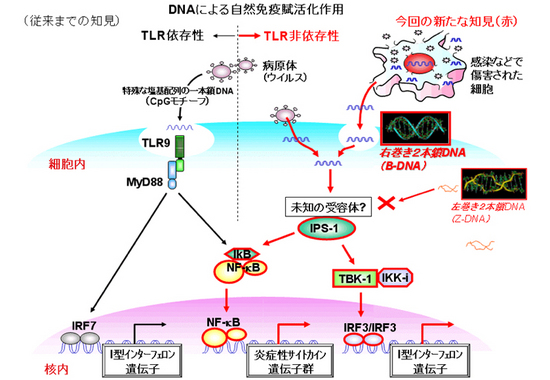
図2 DNAによる自然免疫賦活化作用
核酸(DNA)の自然免疫賦活化作用はTLR9を介する病原体(細菌やウイルス)に多く見られる特殊な塩基配列(CpGモチーフ)によるものが知られていましたが(図の左側)、これまでに本プロジェクトにより、ウイルス、宿主細胞両方に見られるDNAの二本鎖DNAの右巻き構造がTLRに依存しない強いインターフェロン産生能を持つことが示されています(図の右側、赤で記されている部分)。
さらに、樹状細胞などの免疫細胞と、筋肉細胞などの非免疫細胞のDNAワクチン効果に対する寄与も調べました。その結果、免疫細胞のみにTBK1遺伝子を導入したTBK1遺伝子欠損マウスでは、抗原特異的な抗体の産生(液性免疫)およびヘルパーT細胞の誘導が確認できました。一方で、細胞障害性T細胞(CTL)の誘導は、免疫細胞および非免疫細胞ともにTBK1遺伝子を持つマウスのみでしか見られませんでした。
これらのことは、(1) DNAワクチンによる抗体産生には樹状細胞などの免疫細胞でのTBK1依存性の自然免疫活性化経路が重要であること、(2) 細胞性免疫誘導のためにはDNAが主に取り込まれる筋肉細胞などの非免疫細胞における、TBK1依存性の自然免疫活性化シグナルも働いていること、(3) 免疫・非免疫細胞双方における自然免疫活性化が相互に作用し合っていること――を示しています(図3)。
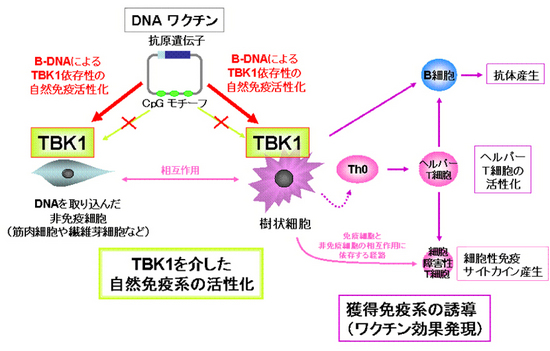
図3 TBK1を介したDNAワクチン効果発現のメカニズムDNAワクチンによる抗体産生には樹状細胞などの免疫細胞でのTBK1依存性の自然免疫活性化経路が重要です。また、細胞性免疫誘導のためにはDNAが主に取り込まれる筋肉細胞などの非免疫細胞における、TBK1依存性の自然免疫活性化シグナルも働き、免疫・非免疫細胞双方における自然免疫活性化が相互に作用し合っています。
最後に、最近TLRに依存しないDNAのセンサー分子として発表されたDAI注11)という分子の遺伝子欠損マウスを作製し、同様にDNAワクチンを投与しました。その結果、DNAワクチンの効果は野生型マウスに投与した場合と変わらなかったことから、TLRに依存しないDNA(B-DNA、DNAワクチン)の認識にDAIは必須ではないことが判明、さらに未知の受容体分子がDNAを認識し、TBK1依存性の自然免疫反応を誘導している可能性が示唆されました。
<今後の展開>
今回の成果は、今まで明らかになっていなかったDNAワクチンの作用メカニズムを解明したことで、DNAワクチンの開発研究や同ワクチンの効果増強に寄与すると思われます。また、抗体産生に特化したDNAワクチンと細胞性免疫も誘導するタイプのDNAワクチンとの作り分けによって、病態に合わせてより効果的なワクチンを開発できることも期待されます。
本研究成果は、DNAをベクターとした遺伝子治療に関しても、新たな知見を与えました。すなわち、今回明らかになった免疫系活性化経路を抑制することにより、投与したDNAを免疫システムから回避させることが可能になります。このことから、より有効な遺伝子の導入と発現の維持が可能になり、効果的な治療につながることが期待されます。
DNAはいくつかの自己免疫疾患、たとえば全身性エリテマトーデス(SLE)(自己のDNAに対する抗体ができる原因不明の疾患)などの発症、増悪の機序に関与している可能性があり、今回の研究成果はこれらの疾患の発症メカニズムの解明、治療薬の開発の一助になるとも期待されています。
最後に、近年までDNAという物質は免疫システムにおいてあまり重要視されていない物質のひとつでしたが、今回の研究成果を含めた最近の知見を総合すると、DNAは免疫システムによって認識され、それに対する自然免疫反応が厳密に制御されていることが明らかになり、DNA認識に関わる研究の深化が期待できます。
<用語解説>
注1)獲得免疫
病原体感染後期の抗原特異的な免疫機構。長期にわたり抗原に対する免疫反応を記憶します。また、獲得免疫系には、B細胞による抗体産生(液性免疫)とヘルパーT細胞や細胞障害性T細胞(CTL: Cytotoxic T Lymphocyte)による細胞性免疫の2つが存在します。
注2)DNAの右巻きの二重らせん構造(B-DNA)
通常、二本鎖DNAはワトソン、クリックが示したように右巻きの二重らせんの構造を取り、B-DNAと称されます。ウイルスやその他の病原体だけでなくヒトの二本鎖DNAのほとんどはこのB-DNAの構造を取っているとされます。二本鎖DNAのなかには左巻きのらせん構造を取るものも知られ、ジグザグ状に見えるのでZ-DNAといわれています。
注3)Tank-Binding Kinase 1(TBK1)
ウイルス感染時におけるインターフェロン産生に重要なシグナル伝達分子のひとつで、細胞内酵素の一種。またTLR3とTLR4におけるインターフェロン産生には必須ですが、TLR9によるインターフェロン産生には関与していないとされています。
注4)自然免疫系
病原体感染初期の感染防御を担う免疫機構。以前は原始的で特異性の無いものと考えられてきましたが、最近、Toll-like receptorの発見、その役割の解析により、自然免疫系が病原体を特異的に認識すること、病原体に適応した反応を引き起こすこと、また感染後期の獲得免疫系の活性化にも重要な役割を果たしていることが明らかとなってきました。
注5)アジュバント
抗原(ワクチン)の免疫原性を高める目的で抗原とともに生体に投与される試薬のこと。自然免疫を活性化するものが多く、その中でも結核菌の死菌を含んだ CFA(Complete Freund Adjuvant)や、病原体由来のリポ多糖(LPS)、核酸(CpG DNA, ポリIC)などが実験的にはよく使用されています。近年、これらのアジュバントの多くはToll様受容体のリガンドであることが判明しました。
注6)CpGモチーフ
TLR9を介する病原体(細菌やウイルス)に多く見られる特殊な塩基配列。
注7)トル様(よう)受容体
Toll-like receptorの和訳でTLRと略され、TLR1からTLR13までが知られています。主に免疫細胞であるマクロファージや樹状細胞、B細胞などに発現するたんぱく質で、病原体に特異的な構造を持つたんぱく質、脂質、核酸などを認識し免疫細胞を活性化します。活性化された細胞では病原体の貪食、排除が促進され、炎症性サイトカイン、インターフェロンなどを産生し、他の細胞に危険信号を与えたり、T細胞などによる獲得免疫系への橋渡しをしています。 TLR9は樹状細胞、B細胞に強く発現しているTLRで、病原体のDNAに多く存在する非メチル化DNAを認識し、サイトカインやI型インターフェロンを誘導します。
注8)遺伝子欠損マウス
特定の遺伝子を機能させなくしたマウスのこと。機能が分からない遺伝子が見つかったとき、遺伝子操作によってその遺伝子を発現しないマウス(遺伝子欠損マウス)を作製し、正常のマウスと比較して機能を調べるのに用います。
注9)I型インターフェロン
ウイルスに感染した時に細胞から分泌されます。主にリンパ球系から産生されるインターフェロンαと非リンパ球系から産生されるインターフェロンβがあり、抗ウイルス、抗がん作用を示すことが知られています。
注10)炎症性サイトカイン
病原体の生体内への侵入があった際、自然免疫系は発熱などの炎症反応を惹起することにより細菌などの病原体を排除します。この炎症反応の原因となるものが炎症性サイトカインです。
注11)DAI
DNA-dependent activator of IFN-regulatory factorsの略。DNA依存性インターフェロン調節因子活性化分子のこと。ZBP1(Z-DNA binding protein 1)とも呼ばれます。
<論文名>
"TANK-binding kinase-1 delineates innate and adaptive immune responses to DNA vaccines" (TBK1はDNAワクチンに対する自然免疫、獲得免疫反応に重要である)
<お問い合わせ先>
審良 静男(あきら しずお)
大阪大学 免疫学フロンティア研究センター 拠点長
独立行政法人 科学技術振興機構 審良自然免疫プロジェクト 研究総括
〒565-0871 大阪府吹田市山田丘3-1
Tel: 06-6879-8303 Fax: 06-6879-8305
E-mail:sakira@biken.osaka-u.ac.jp
石井 健 (いしい けん)
大阪大学 免疫学フロンテイア研究センター 自然免疫学 准教授
大阪大学 微生物病研究所 難治感染症対策研究センター 分子原虫学 准教授
独立行政法人 科学技術振興機構 審良自然免疫プロジェクト グループリーダー
〒565-0871 大阪府吹田市山田丘3-1
Tel: 06-6879-8279 Fax: 06-6879-8283
E-mail:kenishii@biken.osaka-u.ac.jp
世界トップレベル研究拠点
大阪大学 免疫学フロンティア研究センター 事務部
〒565-0871 大阪府吹田市山田丘3-1
Tel: 06-6879-4275 Fax: 06-6879-8266
E-mail: ifrec-office@ifrec.osaka-u.ac.jp
URL: http://www.ifrec.osaka-u.ac.jp/
