News & Topics
オートファジー関連遺伝子Atg16L1の欠損は、エンドトキシンによるIL-1beta産生を増強する。(齊藤助教、審良拠点長らが Nature に掲載)
大阪大学 免疫学フロンティア研究センター 審良静男拠点長と齊藤達哉助教らの研究グループは、同大学 微生物病研究所 細胞制御分野の藤田尚信研究員と吉森保教授らと共同し、グラム陰性細菌の内毒素(エンドトキシン)により引き起こされる炎症制御の新たなメカニズムを明らかにしました。
生物が生きていく上で、蛋白質の代謝制御は非常に重要な役割を果たしています。なかでもオートファジーと呼ばれる蛋白質分解の制御機構は、不溶性の凝集蛋白質の除去に関わることで神経変性疾患の発症に関与し、また細胞内に侵入した病原性細菌の排除を行うことで感染防御にも重要な役割を果たすことが知られています。そこで審良拠点長らは、オートファジーが自然免疫応答時の炎症反応において果たす役割を解明するために、Atg16L1と呼ばれるオートファジーに必須の因子を欠損した遺伝子改変マウスを作製し、解析を行いました。
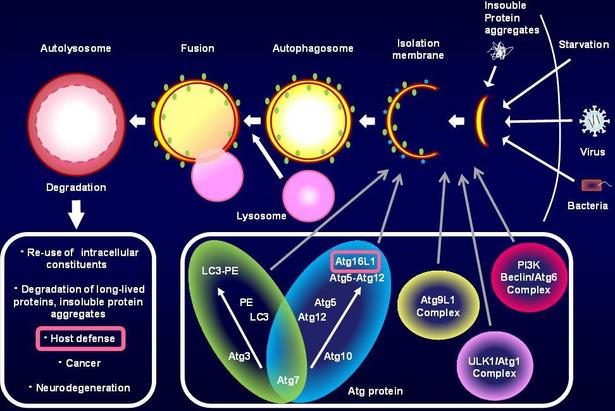
図1. オートファジー
その結果、Atg16L1を欠損したマウスより調整したマクロファージと呼ばれる免疫担当細胞は、グラム陰性菌のエンドトキシンを認識すると、大量のIL-1beta, IL-18と呼ばれる炎症性サイトカインを産生し、強い炎症応答を引き起こすことが分かりました。さらに、Atg16L1を欠損した細胞では痛風の原因となる尿酸結晶による炎症性サイトカイン産生の過剰な誘導も認められました。また、血球系細胞においてAtg16L1分子を欠損したマウスは大腸炎の実験モデルにおいて高い感受性を示し、オートファジーの制御異常が腸炎の発症に関わる可能性が示唆されました。
炎症性サイトカインの過剰産生は腸炎や痛風などの炎症性疾患の原因の一つであり、また本研究によりその役割が明らかとなったAtg16L1分子は、その遺伝子変異とクローン病の発症との関連が指摘されていることから、オートファジーによる炎症応答制御の発見は、炎症性疾患発症のメカニズムを知るうえでの手掛かりとなる可能性を秘めていると考えられ、さらなる解析が望まれます。
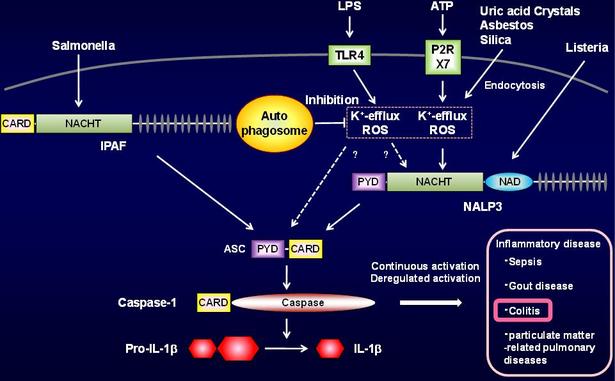
図2. オートファジーによるインフラマソームの制御
主な共同研究者: 藤田尚信(研究員)、吉森保(教授) 大阪大学・微生物病研究所・細胞制御分野
<お問い合わせ先>
齊藤達哉(助教)、審良静男(教授、拠点長)〒565-0871
大阪府吹田市山田丘3-1
大阪大学免疫学フロンティア研究センター(微生物病研究所内)
自然免疫学研究室
Tel: 06-6879-8303 Fax: 06-6879-8305
sakira@biken.osaka-u.ac.jp
