News & Topics
DNAに対する免疫応答に重要な役割を果たす分子を同定 (河合准教授、審良拠点長らが Immunity に掲載)
自然免疫は細菌、ウイルス、寄生虫といった感染病原体の初期認識ならびにその後の炎症反応の惹起や獲得免疫の誘導に重要な役割を果たしている生体防御メカニズムです。DNAウイルスや細菌のゲノム中に存在する二本鎖DNAは自然免疫系により認識され、I型インターフェロン(IFN)や炎症性サイトカインを誘導します。これまでにDNA刺激に応じたI型IFN産生には、リン酸化酵素TBK1が主要な働きをしていることが知られていました。TBK1は刺激に応じて転写因子IRF3をリン酸化しIFNbを含む一連の標的遺伝子の発現を誘導します。また、TBK1と結合しこれを活性化するシグナル伝達分子としてSTING(別名MITA、MPYS、ERIS)が同定されており、STING欠損細胞では二本鎖DNAに対する自然免疫応答が著名に減少しています。しかしながら、DNAを直接認識する細胞内センサーやそのシグナル伝達経路は不明な点が多く残っています。
今回、合成B型DNA [poly (dA:dT)・poly (dT:dA)] DNAを用いて、DNAに対する自然免疫応答を正に制御する分子のスクリーニングを行い、TRIM(tripartite motif)タンパク質ファミリーの一つTRIM56を同定しました。TRIMタンパク質ファミリーは、ヒトやマウスで60種類程度同定されており、その多くはRINGフィンガー型E3ユビキチンリガーゼ活性を持ちます。TRIM56を細胞内に発現させると合成DNA刺激やDNAが引き金となる細菌感染に伴うI型IFNの産生誘導を上昇させる一方TRIM56をノックダウンした細胞ではI型IFN産生が減少しました。興味深いことに、TRIM56をSTINGと共に細胞内に発現させると相乗的にIFNβプロモーターを活性化しました。詳しく調べてみると、TRIM56はユビキチンリガーゼとして機能し、STINGをリジン(K)63型ポリユビキチン化することが分かりました。TRIM56はSTINGの150番目のリジンのユビキチン化を誘導しますが、このリジンをアルギニンに変化させた変異体(STING K150R)はIFNβプロモーターを活性化することができませんでした。さらに、この部位の修飾により、STINGが二量体を形成すること、またこの二量体形成はTBK1との結合に必要であることが分かりました。一方、in vitroにおいて、TRIM56とDNAの結合は認められなかったことから、TRIM56自身はDNAセンサーとして機能しているわけではなく、STINGの調節分子として機能していると予想されます。
STINGは未刺激では小胞体膜に局在していますが,DNA刺激にともない核膜周辺の小胞へと移行することが報告されています。この小胞にはTBK1も含まれており、この小胞内でのSTING―TBK1複合体形成が転写因子IRF3の活性化を誘導するものと考えられています。TRIM56は未刺激状態では細胞質に存在していますが、DNA刺激にともないドット状の構造へと移行し、一部はSTINGが含まれる小胞と共局在しました。興味深いことに、STING K150Rは野生型STINGと同様にDNA刺激にともないTBK1を含む小胞へと移行しました。このことから、STINGのユビキチン化はTBK1を含む小胞への移行には影響をあたえず、むしろ、この小胞内でのTBK1との直接の結合と活性化に必要であるものと考えられます。今後は、STINGの小胞での移行を制御する分子機構の解明が必要です。
今後のDNAセンサーの同定やそのシグナル伝達経路のさらなる解明はDNAウイルスや細菌に対する免疫応答理解にとどまらず、DNA異常認識が起因すると考えられる自己免疫疾患や炎症性疾患の発症機序やDNAワクチン効果発揮メカニズムを理解する上で重要であると考えられます。
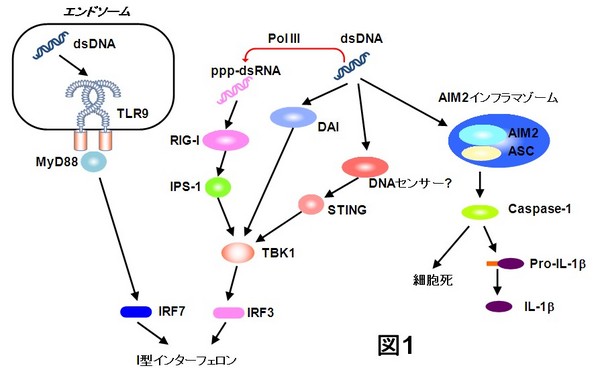
図1 自然免疫によるDNAの認識
DNA認識にかかわるRIG-I様受容体として、TLR9、RIG-I、AIM2インフラマゾーム、DAI以外に未知のDNAセンサーが存在していることが知られている。TLR9はエンドソーム内に遊離したDNAの認識にともないアダプター分子MyD88を介して転写因子IRF7を活性化しI型IFNの産生を誘導する。細胞質においてRIG-IはRNAポリメラーゼIII(Pol III)により転写された2本鎖RNAの5'末端の三リン酸を含む部分を認識し、アダプター分子IPS-1を介してTBK1とIRF3を活性化しI型IFNの産生を誘導する。AIM2インフラマゾームによるDNAの認識はカスパーゼ1の活性化と,それにともなうIL-1β前駆体の切断と活性化型IL-1βの放出を誘導する.I型IFN誘導にかかわるDNAセンサーとしてDAIが同定されているが、未知のDNAセンサーの存在も示唆されている。STINGはDNAによるI型IFNの誘導に必須の細胞内タンパク質である。STINGはTBK1の活性化をとおしてIRF3を活性化する。

図2
(a)TRIM56の構造
RINGフィンガードメイン、Bボックスドメイン、コイルドコイルドメインをもつ。
(b)TRIM56によるSTINGの制御
TRIM56はSTINGのK63ユビキチン化を誘導する。この修飾によりSTINGは2量体を形成してTBK1をリクルートする。その結果、TBK1が活性化されIRF3のリン酸化しI型IFNの産生が誘導される。
Article
<お問い合わせ先>
河合 太郎
tkawai@biken.osaka-u.ac.jp
審良 静男(あきら しずお)
sakira@biken.osaka-u.ac.jp
自然免疫学研究室
大阪大学免疫学フロンティア研究センター (IFReC)
